|
La expedición de la Resolución No. 20049 de 2024, por parte de la Superintendente de Industria y Comercio, por medio de la cual se concede la primera licencia obligatoria por razones de interés público para un medicamento en el país es un hecho histórico, máxime en un contexto actual en el que se incrementa la presión tecnológica en el gasto farmacéutico con un enfoque en enfermedades crónicas y de alto costo; con desafíos socioeconómicos y epidemiológicos importantes fruto del cambio climático, el contexto político regional y global y los procesos migratorios y de refugio; con una agenda 2030 de desarrollo sostenible al frente; y con un aumento progresivo en los casos de VIH en el país y las registradas barreras de acceso a los medicamentos para su tratamiento.
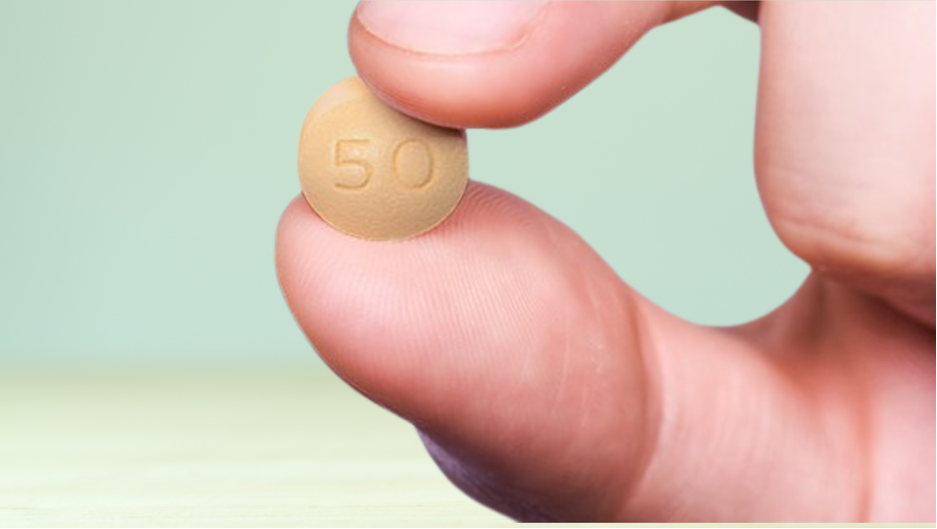
Las licencias obligatorias son una salvaguarda de la salud pública consagrada en la normativa internacional para permitir a los países priorizar el derecho humano fundamental a la salud sobre la propiedad intelectual. En Colombia, la protección de la propiedad intelectual para los medicamentos esenciales ha estado en vigor desde 1994, y es solo hasta el 2024, treinta años después, que el Gobierno ejerce su derecho a utilizar esta salvaguarda para garantizar el acceso de la población colombiana, migrante y refugiada que vive con VIH al tratamiento recomendado como primera línea por la OMS desde 2019, y por la Guía de Práctica Clínica de Colombia para la atención de la infección por VIH/SIDA de 2021. El otorgamiento de la licencia obligatoria al Ministerio de Salud y Protección Social representa un avance significativo en la conciencia jurídica de las herramientas disponibles para que el Estado cumpla con su deber de proteger el derecho a la salud de la población. Además, demuestra coherencia institucional al abordar de manera responsable el mecanismo regulado en el Decreto 1074 de 2014, titulado "Procedimiento para la declaratoria de existencia de razones de interés público del artículo 65 de la decisión 486 de 2000", convirtiéndolo en una herramienta necesaria y útil para superar los desafíos epidemiológicos revelados por la sindemia actual, planteada por las pandemias de Covid-19, VIH y enfermedades crónicas, así como las endemias regionales de enfermedades como malaria, chagas y dengue, y los riesgos medioambientales. Se espera que la implementación de esta licencia obligatoria amplíe el acceso al dolutegravir para las personas que viven con VIH que lo necesitan. Según el análisis del Comité Técnico Interinstitucional creado para este proceso, "se estima que el tratamiento anual con dolutegravir por paciente, bajo el precio reportado en el SISMED, tendría un costo de COP$4.818.894 frente al ofrecido por la OPS con un costo anual de COP$173.893, lo que implica una diferencia de COP$4.645.001 con lo cual se podría atender a 27 personas más que con la molécula comercial". Este cambio de precio permitirá al país proporcionar el dolutegravir a todas las personas (adultes, adolescentes, niñes, mujeres gestantes) con diagnóstico de infección por VIH sin experiencia previa con antirretrovirales. Los tratamientos antirretrovirales basados en esta molécula tienen mejores resultados y menores efectos adversos para los pacientes. Además, al ser el Ministerio de Salud el encargado de adquirir directamente el medicamento, se podrá reducir significativamente el riesgo de escasez de dolutegravir, aumentando así su frecuencia de uso. El éxito del otorgamiento de esta primera licencia obligatoria en el país dependerá en gran medida de la colaboración de todos los actores, incluidas las farmacéuticas dueñas de la patente (ViiV Healthcare (ViiV), cuyos dueños son Pfizer, GlaxoSmithKline (GSK) y Shionogi; y SHIONOGI & CO., LTD.) así como AFIDRO, para poder seguir adelante sin traumatismos en la implementación de esta licencia obligatoria para uso gubernamental y así lograr llegar a todes les pacientes que lo necesitan, haciendo un uso eficiente de los recursos públicos limitados. Las multinacionales farmacéuticas objetan la decisión del gobierno de Colombia argumentando que perjudica los esfuerzos e inversiones en innovación. La experiencia de los países en desarrollo muestra que las innovaciones protegidas con propiedad intelectual, debido a sus altos precios, no benefician a sus poblaciones y amenazan la sostenibilidad de sus sistemas de salud. La experiencia vivida durante la pandemia de Covid-19 evidenció la inaceptable inequidad en la distribución de vacunas, así como el bloqueo a la transferencia de conocimiento y capacidades para abordar la crisis a nivel mundial. Las Licencias Obligatorias alivian el impacto de este modelo de innovación centrado en enfermedades negocio, pero solo beneficiosas para les más ricos, financiado por todes. Juliana Lopez, Directora de la Fundación IFARMA “Resaltamos el esfuerzo y la persistencia de quienes durante todos estos años han hecho parte de esta lucha. Sin las personas que fueron y son parte del movimiento que incide directa o indirectamente en este favorable hecho no estaríamos celebrando este hito en la historia del país, sin los fracasos anteriores no podríamos estar contando esta historia de éxito. Esta lucha por el acceso nos corresponde a todes, por ende, resaltamos el valor de la empatía como una forma de resistencia a la privatización de la salud y los monopolios farmacéuticos. ¡RESISTIMOS, PERSISTIMOS Y EXISTIMOS!”. Harold Silva, abogado de la Fundación IFARMA “Reconocemos que esta decisión administrativa es un gran avance en temas de acceso al derecho de la salud para las personas y la salud pública en general. Aunque hayan pasado 29 años para obtener la primera licencia obligatoria en Colombia, desde la entrada en vigor de los ADPIC, y 22 años desde la Declaración de la Cuarta Conferencia Ministerial, celebrada en Doha , nunca es tarde por parte de un Estado garantizar los derechos fundamentales a la salud y a la vida. Las actuaciones realizadas por parte del Ministerio de Comercio, el Ministerio de Salud y Protección Social, el Departamento Nacional de planeación, y finalmente la Superintendencia de Industria y Comercio, permiten evidenciar que los Estados Miembros de la OMC, si pueden hacer uso de las herramientas brindadas en normas internacionales y nacionales para garantizar el interés general de la población.” Finalmente, no podemos dejar de mencionar que confiamos en recibir pronto noticias igualmente favorables en términos de licenciamiento para nuestra solicitud de declaratoria de interés público a los antivirales de acción directa para el tratamiento de la hepatitis C con fines de licencia obligatoria, que radicamos ante el Ministerio de Salud hace ocho años y siete meses, en octubre del 2015, y que no ha tenido avances significativos desde junio del 2023. ¡Gracias a todes les que han contribuido al logro de este hito en el acceso a medicamentos que salvan vidas! Que honremos felices este momento y ¡seguimos adelante!
0 Comentarios
Francisco Rossi. El 30 de octubre pasado, el tribunal decretó, como medida cautelar de urgencia, ordenar al Ministerio de Salud y al INVIMA, presentar en un plazo de 10 días un plan de respuesta a la crisis de desabastecimiento de medicamentos que se vive en Colombia.
Esta medida cautelar, hay que recordarlo, se tomó en respuesta a una acción popular presentada en 2019 y que la procuraduría ha considerado pertinente dar traslado precisamente por estos días. Procuraduría que ya completa más de un año con la tesis de que el desabastecimiento/escasez de medicamentos en el país es el resultado de una acción deliberada del gobierno en general y del Ministerio de salud y el INVIMA en particular, por generar una crisis en el sistema de salud para justificar la reforma que se tramita en el congreso. Tesis que se traduce en que el INVIMA demora los registros, y que el Ministerio no compra y distribuye los medicamentos que la gente necesita. Procuraduría que de manera reiterada produce anuncios en los medios de comunicación, repitiendo su tesis de corte político, pero que se resiste a comprender que el desabastecimiento/escasez de medicamentos, es una consecuencia estructural del hecho de que la producción se encuentra casi totalmente en el sector privado. No hay peor entendedor que el que no quiere entender que la decisión de producir o no, de aumentar o reducir la producción de cualquier medicamento, es el titular del registro sanitario, y que las competencias del Ministerio y del INVIMA no son ni producir ni distribuir ni siquiera incluso la de direccionar el mercado. A lo sumo definir incentivos. Y si algo no puede hacer un funcionario público es exceder sus competencias. En otros países, el Estado juega un papel relevante al adquirir medicamentos como gran comprador del sistema de salud. En ese escenario, los productores apuntan a competir por los productos que el Estado licita. Ese no es el sistema de salud de Colombia. En nuestro país, el Ministerio de salud no compra medicamentos, con excepciones minoritarias en los antiguos programas verticales y los productos de control especial. La procuraduría lo sabe, y sabe también que, buena parte de los problemas de desabastecimiento/escasez tienen que ver con la compleja red de contratos entre las EPS, las IPS y los operadores logísticos. Eso también los saben los actores que participan del sistema de salud y los productores, los operadores logísticos, los prescriptores y los profesionales de la salud. Y se lo han hecho saber tanto a los organismos de control como a los medios de comunicación. Pero al parecer hay prioridades, y la urgencia de desacreditar al gobierno y a su propuesta de reforma, exigen ignorar los hechos, la normatividad y la responsabilidad pública. Cuando así se juega con la institucionalidad, se corre el riesgo de caer en el ridículo, que es lo que ha pasado particularmente con la convocatoria a una audiencia de seguimiento previa al desacato, tanto al Ministerio de Salud como al INVIMA. En la providencia, extensamente difundida en medios de comunicación como es ya costumbre, se emplaza al Ministro de Salud y Protección Social, Guillermo Alfonso Jaramillo Martínez y al Director general del INVIMA, Dr. Germán Velásquez Arango, a que comparezcan a explicar por que no han dado cumplimiento a la media cautelar. Es inexcusable para un magistrado del tribunal, que no sepa que el Dr Velásquez Arango no es el director del INVIMA. En la providencia, explica el magistrado que las respuestas, tanto del INVIMA como del Ministerio, cuestionan la medida cautelar en lugar de cumplirla. No podía ser de otra manera, dado que no tiene instrumentos legales para “asegurar la disponibilidad de los medicamentos y de los demás principios activos que presentan oferta insuficiente frente a las necesidades de la población”. Una orden confusa en la que se combinan inapropiadamente los términos, ya que todo medicamento tiene un principio activo y en la que se ignora por completo el funcionamiento del mercado de medicamentos y el papel de las EPS como intermediarios entre los proveedores de medicamentos y las IPS. Una orden que no se puede cumplir sin exceder las funciones y competencias del Ministerio y el INVIMA. A su vez, el INVIMA informa al tribunal que las tales 27.904 solicitudes de registro de medicamentos que ordena resolver no son tales y que, en la práctica, podrían llegar a ser 65 las que tienen relación con desabastecimiento/escasez. Finalmente, ordena el juez al INVIMA y al Ministerio, definir estrategias para facilitar el acceso a la materia prima requerida para la fabricación de medicamentos. Una vez más el tribunal desconoce que la decisión de importar o no, y la cantidad a importar, es una decisión del fabricante, cuando evidentemente se trata de productos de fabricación local. Se olvida de que una fracción importante de los productos desabastecidos o escasos son importados. Las normas solamente definen los requisitos que debe cumplir el importador y las especificaciones de la materia prima en cuestión. Ni el INVIMA ni el Ministerio facilitan o dificultan. Como muchas de las cosas de la salud, estas decisiones se dejan al mercado y a la iniciativa privada. Hacen el ridículo la procuraduría y el tribunal, y traen a la memoria la anécdota aquella de cuando a la entonces Clínica San Pedro Claver del ISS, llegó una orden judicial conminando a la clínica a realizar en el término de 48 horas un trasplante de riñón a un paciente que lo requería. A lo que contestó la Clínica, sírvase señor juez enviar el respectivo riñón. Felicitamos al Gobierno de Colombia y al Ministerio de Salud por haber cumplido la promesa de dar prioridad a la salud sobre los negocios. Aplaudimos la rigurosidad con la que se ha seguido el debido proceso y dado respuesta a todas las observaciones presentadas por los interesados. Nos unimos a las Organizaciones de la Sociedad Civil que aportaron al proceso el sentir de las personas con VIH y, al mismo tiempo, rechazamos las presiones y los ataques al proceso y a los funcionarios.
Las ONG comprometidas con el acceso a medicamentos creímos que con la pandemia, en todos los países del mundo se suspenderían o flexibilizarían los Derechos de Propiedad Intelectual, especialmente las patentes, como lo propusieron India y Sudáfrica. Lamentamos que no haya sido posible, pero recordamos muy bien que este rechazo fue justificado en la OMC por la existencia de las flexibilidades y salvaguardias. Hemos visto con sorpresa cómo, ante la decisión del gobierno de Colombia, han reaparecido argumentos que considerábamos superados, como el cuestionamiento a la calidad de los genéricos, el riesgo de afectar la innovación o la calificación de las Licencias Obligatorias como una expropiación. ¡Rechazamos estas falacias! También esperamos la colaboración a nivel político regional, especialmente de los países con capacidad de producción local para proporcionar ayuda humanitaria al Estado colombiano y a las personas que viven con el VIH. 
Recientemente el Instituto de las Américas publicó el libro titulado Sociedades, crisis y salud pública en Europa, América Latina y el Caribe, publicación que aborda el impacto de la COVID-19 desde diversos aspectos aspectos y distintas partes del mundo.
La Fundación IFARMA participó en la producción de este libro con la edición del capítulo 13, titulado Participación de la sociedad civil en las políticas públicas en salud (página 203). El capítulo, redacción que asumieron Claudia Vargas Peláez -Directora de IFARMA- y Francisco Rossi Buenaventura - Asesor Senior de la organización-, comparte reflexiones desde la experiencia de la sociedad civil colombiana en la pandemia. El Instituto de las Américas es un grupo de interés científico que se creó en 2007 y que hoy lo orienta la Universidad Sorbonne Nouvelle-Paris 3 y el Campus Condorcet. El Instituto promueve el intercambio intelectual a nivel nacional, europeo y mundial sobre los principales temas de investigación que afectan a las Américas. La salud del medio ambiente y su relación con nuestra salud es un tema que debemos asumir.
 Una respuesta efectiva de la Organización Mundial de Comercio (OMC) frente a las restricciones que la propiedad intelectual impone para acceder al diagnóstico y al tratamiento de la COVID-19, así como a las vacunas, es la solicitud que más de 200 organizaciones sociales del mundo presentaron a esa entidad multilateral. El pasado mes de febrero, distintas organizaciones enviaron una carta abierta de la sociedad civil a la directora de la OMC, Ngozi Okonjo-Iweala, y a su directora adjunta, Anabel González, en la que expresan su preocupación por la situación que se registra a nivel mundial para dar una respuesta efectiva a la COVID-19, consecuencia de las barreras que impone la propiedad intelectual. La carta abierta de la sociedad civil fue suscrita por Amnistía Internacional, Pan para el Mundo, la Coalición Internacional de Preparación para el Tratamiento (ITPC) y las organizaciones colombianas Fundación IFARMA y Misión Salud, entre otras.  El Instituto Nacional de Vigilancia de Medicamentos y Alimentos (INVIMA), y el Sistema de Precios de Medicamentos (Sismed) deben mejorar la calidad, pertinencia, disponibilidad y oportunidad de la información que producen sobre medicamentos. Esta es una de las recomendaciones que presenta el documento titulado Impacto de la protección a los datos de prueba con exclusividad (Decreto 2085 de 2002) 2012 – 2019, publicado recientemente por la Fundación IFARMA. Este documento (policy brief) se produce en el contexto del Acuerdo Marco de Cooperación 1-2020 que IFARMA suscribió con la Asociación de Industrias Farmacéuticas en Colombia (ASINFAR), que establece la cooperación entre las partes con el propósito de realizar investigación aplicada en el campo de las políticas farmacéuticas.  La resistencia a los antibióticos, -es decir, tomarlos y que no surtan el efecto esperado- es una de las consecuencias que trae el consumo inapropiado de estos medicamentos. Frente a esta situación, cada año se realiza la ‘Semana Mundial de Concienciación sobre el Uso de los Antimicrobianos’, evento de sensibilización y educación sobre el uso asertivo y pertinente de estos medicamentos, que va ganando más espacio y audiencia en cada edición anual. Con el propósito de facilitar y divulgar información sobre este tema relevante para la salud de las comunidades, la fundación IFARMA, en asocio con Universidades Aliadas para Medicamentos Esenciales (UAEM), el semillero de “Edwin Bernal, Propiedad intelectual y Acceso a medicamentos” de la Facultad de Derecho, el semillero de “Estudio de la investigación preclínica y clínica de los medicamentos para su desarrollo y aplicación” y el Consultorio de atención Primaria en salud de la Facultad de Medicina de la Universidad Militar Nueva Granada (UMNG), realizaron distintas actividades de sensibilización en distintos lugares de Bogotá, en el marco de la Semana Mundial. Las distintas actividades – que fueron posibles con el apoyo de la organización South Centre, con sede en Ginebra (Suiza)- permitieron llevar la información a más de 1.200 personas. 
Más de 50 organizaciones sociales de distintas partes del mundo enviaron una carta al presidente de Estados Unidos, Joseph Biden, solicitando que asuma el liderazgo y cumpla su promesa de hacer frente a la COVID-19.
El mensaje enviado al mandatario el 20 de septiembre precisa que durante la 76 sesión de la Asamblea General de Naciones Unidas él será anfitrión de una cumbre de vacunas en la que participarán otros líderes mundiales y la cual será el escenario para anunciar el objetivo de vacunar al 70% de la población mundial para el próximo año.  Bogotá.- Así lo expresó Claudia Marcela Vargas Peláez, directora de la Fundación IFARMA, durante su intervención en la audiencia pública que realizó la Comisión VI del Senado de la República el pasado 4 de marzo, en la sede la Universidad EAN (Escuela de Administración de Negocios). La audiencia pública, convocada por el senador Iván Darío Agudelo Zapata, fue el escenario para conocer los puntos de vista de distintos actores sociales sobre el proyecto de ley que busca establecer las bases de la Política Nacional para la Seguridad Farmacéutica (Proyecto de Ley 372 de 2020). En la apertura del evento, el Ministro de Salud, Fernando Ruíz Gómez, dijo que la audiencia dará luces sobre el tema y que se tienen retos a futuro, en un tema tan importante para el sistema de salud como la seguridad farmacéutica. |
|